Ο Ευρωπαϊκός Οργανισμός Φαρμάκων συνέστησε τη χορήγηση άδειας κυκλοφορίας υπό όρους στην Ευρωπαϊκή Ένωση (ΕΕ) για το Rezdiffra (resmeritom) για τη θεραπεία ενηλίκων με μη κιρρωτική μεταβολική δυσλειτουργία που σχετίζεται με στεατοηπατίτιδα (MASH) με μέτρια έως προχωρημένη ίνωση του ήπατος, σε συνδυασμό με δίαιτα και άσκηση.
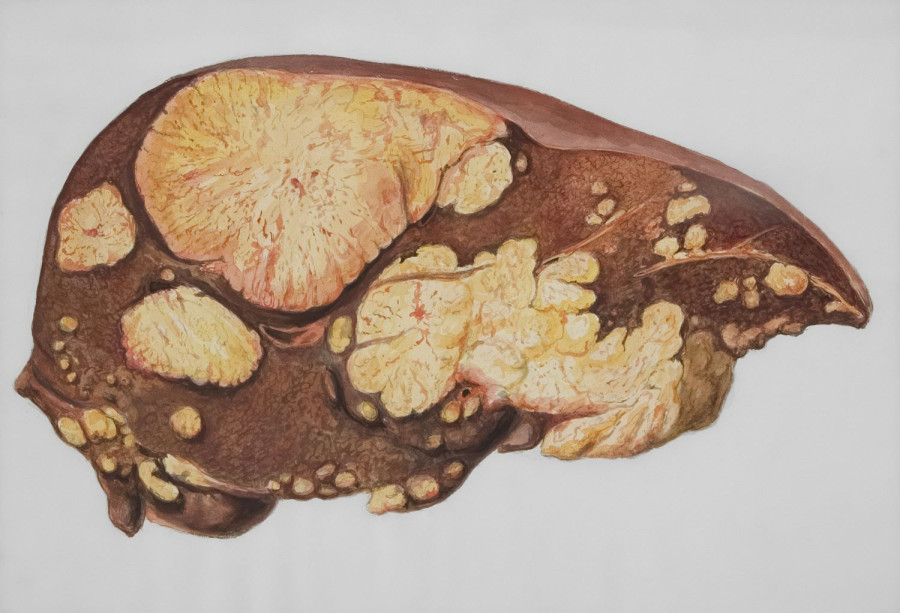
Η στεατοηπατίτιδα είναι μια σοβαρή ασθένεια όπου οι εναποθέσεις λίπους συσσωρεύονται στο ήπαρ προκαλώντας φλεγμονή και συνδέεται συχνά με διάφορες καρδιαγγειακές και μεταβολικές παθήσεις και, εάν αφεθεί χωρίς θεραπεία, μπορεί να οδηγήσει σε κίρρωση (σοβαρή και μόνιμη ουλοποίηση του ήπατος) και καρκίνο. Επί του παρόντος, δεν υπάρχει εγκεκριμένη θεραπεία για το MASH στην ΕΕ.
Η δραστική ουσία του Rezdiffra είναι η ρεσμετιρόμη, μια ηπατική θεραπεία, η οποία διεγείρει έναν υποδοχέα θυρεοειδικής ορμόνης (THR-β) στο ήπαρ, μειώνοντας τη συσσώρευση λίπους στο ήπαρ, τη φλεγμονή και την ηπατική ίνωση που χαρακτηρίζονται από ουλές και πάχυνση των ιστών.
Κλινική μελέτη
Η γνώμη της επιτροπής φαρμάκων για τον άνθρωπο (CHMP) του EMA βασίζεται σε δεδομένα από μία βασική τυχαιοποιημένη, ελεγχόμενη κλινική μελέτη. Ο αιτών υπέβαλε τα αποτελέσματα μιας ενδιάμεσης ανάλυσης με βάση ένα υποσύνολο συμμετεχόντων μετά από ένα έτος θεραπείας.
Η μελέτη περιελάμβανε συνολικά 917 ασθενείς με ηπατική ίνωση σταδίου F2 (μέτρια) και F3 (προχωρημένη) κατά την έναρξη της μελέτης. Οι συμμετέχοντες έλαβαν 80 mg resmeritom (306), 100 mg resmeritom (308) ή εικονικό φάρμακο (303). Τα αποτελέσματα μετά από 12 μήνες έδειξαν ότι το 30% των ασθενών στις ομάδες των 100 mg resmeritom και το 26% των ασθενών στις ομάδες των 80 mg πέτυχαν λύση του MASH χωρίς επιδείνωση της ίνωσης, σε σύγκριση με το 10% στην ομάδα του εικονικού φαρμάκου. Επιπλέον, το 29% των ασθενών που έλαβαν 100 mg resmeritom και το 27% εκείνων που έλαβαν 80 mg resmeritom παρουσίασαν βελτίωση των ουλών στο ήπαρ (ίνωση) και καμία επιδείνωση του MASH, σε σύγκριση με το 17% εκείνων που έλαβαν εικονικό φάρμακο.
Η CHMP έκρινε ότι τα αποτελέσματα της κύριας δοκιμής κατέδειξαν την αποτελεσματικότητα του Rezdiffra.
Δεδομένα και ανεπιθύμητες ενέργειες
Το συμπέρασμα σχετικά με τις ευεργετικές επιδράσεις υποστηρίχθηκε από την υποβολή δύο μελετών που διεξήχθησαν σε ελαφρώς διαφορετικό πληθυσμό, οι οποίες εμφανίζουν εν μέρει παρόμοια χαρακτηριστικά με τον κύριο πληθυσμό-στόχο. Δεδομένου ότι η βασική δοκιμή και μία από τις δύο υποστηρικτικές δοκιμές βρίσκονται σε εξέλιξη, η CHMP ζήτησε από τον αιτούντα να ολοκληρώσει αυτές τις δύο μελέτες, καθώς είναι απαραίτητες για την παροχή περαιτέρω δεδομένων σχετικά με την αποτελεσματικότητα του Rezdiffra.
Οι πιο συχνές ανεπιθύμητες ενέργειες σε ασθενείς που έλαβαν θεραπεία με Rezdiffra ήταν διάρροια, ναυτία και κνησμός.
Το Rezdiffra συνιστάται για χορήγηση άδειας κυκλοφορίας υπό όρους, έναν από τους ρυθμιστικούς μηχανισμούς της ΕΕ για τη διευκόλυνση της έγκαιρης πρόσβασης σε φάρμακα που καλύπτουν ανεκπλήρωτες ιατρικές ανάγκες. Αυτός ο τύπος έγκρισης επιτρέπει στον Οργανισμό να συστήσει ένα φάρμακο για άδεια κυκλοφορίας με λιγότερο πλήρη δεδομένα από τα κανονικά αναμενόμενα, εάν το όφελος από την άμεση διαθεσιμότητα ενός φαρμάκου στους ασθενείς αντισταθμίζει τον κίνδυνο που ενέχει το γεγονός ότι δεν είναι ακόμη διαθέσιμα όλα τα δεδομένα.
Η γνώμη που εγκρίθηκε από την CHMP αποτελεί ένα ενδιάμεσο βήμα στην πορεία του Rezdiffra προς την πρόσβαση των ασθενών. Η γνωμοδότηση θα αποσταλεί τώρα στην Ευρωπαϊκή Επιτροπή για την έκδοση απόφασης σχετικά με τη χορήγηση άδειας κυκλοφορίας σε ολόκληρη την ΕΕ. Μόλις χορηγηθεί η άδεια κυκλοφορίας, οι αποφάσεις σχετικά με την τιμή και την αποζημίωση θα ληφθούν σε επίπεδο κάθε κράτους μέλους, λαμβάνοντας υπόψη τον δυνητικό ρόλο/χρήση αυτού του φαρμάκου στο πλαίσιο του εθνικού συστήματος υγείας της εν λόγω χώρας.